Κεφάλαιο 2: Μίγματα
Καθαρές ουσίες και μίγματα
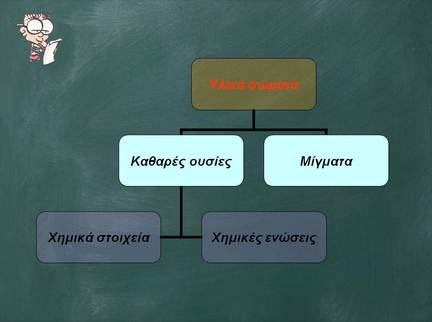
Τα υλικά από τα οποία είναι κατασκευασμένα διάφορα αντικείμενα, διακρίνονται σε δύο μεγάλες κατηγορίες: τις καθαρές ουσίες και τα μίγματα.
Καθαρές ουσίες ονομάζονται τα υλικά που έχουν σταθερή σύσταση, η οποία δεν εξαρτάται από τον τρόπο παρασκευής τους.
π.χ. η ζάχαρη, το αλάτι, ο χαλκός, ο σίδηρος, ο χρυσός, το οξυγόνο.
Μίγματα ονομάζονται οι ουσίες που δεν έχουν σταθερή σύσταση, αλλά αυτή εξαρτάται από τον τρόπο παρασκευής τους.
π.χ. το αλατόνερο, το ζαχαρόνερο, ο μπρούντζος, ο ατμοσφαιρικός αέρας, ο πηλός, ο χυμός πορτοκαλιού.
Τα μίγματα προκύπτουν από την ανάμιξη δύο ή περισσότερων καθαρών ουσιών, που ονομάζονται συστατικά του μίγματος.
Τα συστατικά ενός μίγματος διατηρούν τις ιδιότητές τους.
Ο διαχωρισμός των συστατικών ενός μίγματος μπορεί να γίνει με πολλούς τρόπους:
Καθαρές ουσίες ονομάζονται τα υλικά που έχουν σταθερή σύσταση, η οποία δεν εξαρτάται από τον τρόπο παρασκευής τους.
π.χ. η ζάχαρη, το αλάτι, ο χαλκός, ο σίδηρος, ο χρυσός, το οξυγόνο.
Μίγματα ονομάζονται οι ουσίες που δεν έχουν σταθερή σύσταση, αλλά αυτή εξαρτάται από τον τρόπο παρασκευής τους.
π.χ. το αλατόνερο, το ζαχαρόνερο, ο μπρούντζος, ο ατμοσφαιρικός αέρας, ο πηλός, ο χυμός πορτοκαλιού.
Τα μίγματα προκύπτουν από την ανάμιξη δύο ή περισσότερων καθαρών ουσιών, που ονομάζονται συστατικά του μίγματος.
Τα συστατικά ενός μίγματος διατηρούν τις ιδιότητές τους.
Ο διαχωρισμός των συστατικών ενός μίγματος μπορεί να γίνει με πολλούς τρόπους:
- Διαλογή
- Απόχυση
- Εξάτμιση
- Χρωματογραφία
- Μαγνητικός διαχωρισμός
- Φιλτράρισμα
- Απόσταξη
1. Μελετάμε τα μίγματα
Υπάρχουν μίγματα και στις τρεις φυσικές καταστάσεις της ύλης.
π.χ. Ο πηλός είναι ένα στερεό μίγμα που αποτελείται από νερό και χώμα.
Το αλατόνερο είναι ένα υγρό μίγμα που αποτελείται από νερό και αλάτι.
Ο ατμοσφαιρικός αέρας είναι ένα αέριο μίγμα που αποτελείται από άζωτο, οξυγόνο και άλλα αέρια.
Ανάλογα με το αν μπορούμε να διακρίνουμε ή όχι τα συστατικά ενός μίγματος, τα χωρίζουμε σε ετερογενή μίγματα και ομογενή μίγματα.
Ετερογενή είναι τα μίγματα που μπορούμε να διακρίνουμε τα συστατικά τους με γυμνό μάτι ή μικροσκόπιο.
π.χ. Ο πηλός είναι ένα στερεό μίγμα που αποτελείται από νερό και χώμα.
Το αλατόνερο είναι ένα υγρό μίγμα που αποτελείται από νερό και αλάτι.
Ο ατμοσφαιρικός αέρας είναι ένα αέριο μίγμα που αποτελείται από άζωτο, οξυγόνο και άλλα αέρια.
Ανάλογα με το αν μπορούμε να διακρίνουμε ή όχι τα συστατικά ενός μίγματος, τα χωρίζουμε σε ετερογενή μίγματα και ομογενή μίγματα.
Ετερογενή είναι τα μίγματα που μπορούμε να διακρίνουμε τα συστατικά τους με γυμνό μάτι ή μικροσκόπιο.
Ομογενή είναι τα μίγματα που δεν μπορούμε να διακρίνουμε τα συστατικά τους με γυμνό μάτι ή μικροσκόπιο. Τα ομογενή μίγματα ονομάζονται και διαλύματα.
Τα διαλύματα έχουν την ίδια σύσταση και τις ίδιες ιδιότητες σε όλη τη μάζα τους.
Τα διαλύματα έχουν την ίδια σύσταση και τις ίδιες ιδιότητες σε όλη τη μάζα τους.
ΜΕΛΕΤΑΜΕ ΤΑ ΜΙΓΜΑΤΑ
View more presentations or Upload your own.
|
|
|
Διαδραστική άσκηση στα μίγματα (Αγγλικά) - εδώ
2. Μελετάμε τα διαλύματα
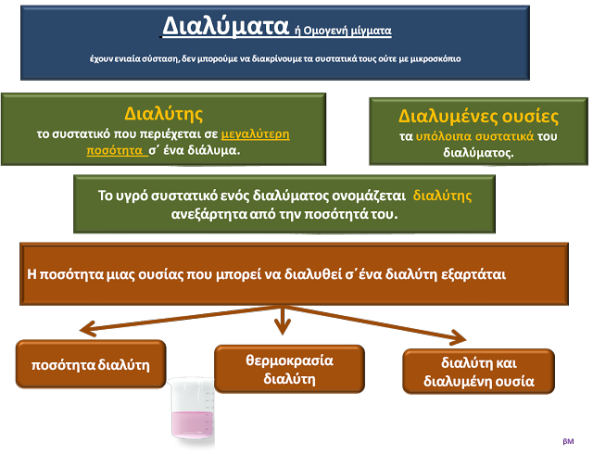
Διαλύματα ονομάζονται τα ομογενή μίγματα.
Σε κάθε διάλυμα, διακρίνουμε τον διαλύτη και τις διαλυμένες ουσίες.
Διαλύτης είναι το συστατικό του μίγματος που διαλύει τις υπόλοιπες ουσίες και βρίσκεται σε μεγαλύτερη ποσότητα.
Αν ένα συστατικό του διαλύματος είναι υγρό, τότε αυτό ονομάζεται διαλύτης, ανεξάρτητα από την ποσότητά του.
Διαλυμένες ουσίες ονομάζονται οι ουσίες που διαλύονται και είναι τα υπόλοιπα συστατικά του διαλύματος, εκτός από τον διαλύτη.
π.χ. Αν στο νερό διαλύσουμε αλάτι και ζάχαρη, σχηματίζεται ένα διάλυμα που διαλύτης είναι το νερό και διαλυμένες ουσίες το αλάτι και η ζάχαρη.
Η ποσότητα μιας ουσίας που μπορεί να διαλυθεί σε ορισμένη ποσότητα ενός διαλύτη, είναι περιορισμένη.
Η αδιάλυτη ουσία που "κάθεται" στον πυθμένα ενός δοχείου ονομάζεται ίζημα.
Τα διαλύματα στα οποία δεν μπορεί να διαλυθεί άλλη ποσότητα διαλυμένης ουσίας, ονομάζονται κορεσμένα.
Σε κάθε διάλυμα, διακρίνουμε τον διαλύτη και τις διαλυμένες ουσίες.
Διαλύτης είναι το συστατικό του μίγματος που διαλύει τις υπόλοιπες ουσίες και βρίσκεται σε μεγαλύτερη ποσότητα.
Αν ένα συστατικό του διαλύματος είναι υγρό, τότε αυτό ονομάζεται διαλύτης, ανεξάρτητα από την ποσότητά του.
Διαλυμένες ουσίες ονομάζονται οι ουσίες που διαλύονται και είναι τα υπόλοιπα συστατικά του διαλύματος, εκτός από τον διαλύτη.
π.χ. Αν στο νερό διαλύσουμε αλάτι και ζάχαρη, σχηματίζεται ένα διάλυμα που διαλύτης είναι το νερό και διαλυμένες ουσίες το αλάτι και η ζάχαρη.
Η ποσότητα μιας ουσίας που μπορεί να διαλυθεί σε ορισμένη ποσότητα ενός διαλύτη, είναι περιορισμένη.
Η αδιάλυτη ουσία που "κάθεται" στον πυθμένα ενός δοχείου ονομάζεται ίζημα.
Τα διαλύματα στα οποία δεν μπορεί να διαλυθεί άλλη ποσότητα διαλυμένης ουσίας, ονομάζονται κορεσμένα.
Νερό: Ο παγκόσμιος διαλύτης.
Το νερό χρησιμοποιείται πολύ συχνά ως διαλύτης, αφού οι ουσίες που διαλύονται σε αυτό είναι πάρα πολλές. Σε αυτό διαλύονται στερεές, υγρές και αέριες ουσίες (π.χ. στο νερό της θάλασσας υπάρχει διαλυμένο αλάτι αλλά και οξυγόνο. Για αυτό το νερό ονομάζεται παγκόσμιος διαλύτης.
Το νερό χρησιμοποιείται πολύ συχνά ως διαλύτης, αφού οι ουσίες που διαλύονται σε αυτό είναι πάρα πολλές. Σε αυτό διαλύονται στερεές, υγρές και αέριες ουσίες (π.χ. στο νερό της θάλασσας υπάρχει διαλυμένο αλάτι αλλά και οξυγόνο. Για αυτό το νερό ονομάζεται παγκόσμιος διαλύτης.
|
|
|
Όλες οι ουσίες δε διαλύονται το ίδιο εύκολα στο νερό. Ουσίες που διαλύονται εύκολα ονομάζονται ευδιάλυτες, ενώ αυτές που διαλύονται δύσκολα ονομάζονται δυσδιάλυτες.
Η ποσότητα μιας ουσίας που μπορεί να διαλυθεί σε ένα διαλύτη εξαρτάται από:
Η ποσότητα μιας ουσίας που μπορεί να διαλυθεί σε ένα διαλύτη εξαρτάται από:
- Την ποσότητα του διαλύτη: Όσο μεγαλύτερη είναι η ποσότητα του διαλύτη, τόσο μεγαλύτερη είναι και η ποσότητα της ουσίας που μπορεί να διαλυθεί σ' αυτόν.
- Τη θερμοκρασία: Όσο μεγαλύτερη είναι η θερμοκρασία του διαλύτη, τόσο μεγαλύτερη είναι και η ποσότητα της ουσίας που μπορεί να διαλυθεί σ' αυτόν.
- Το είδος της ουσίας: Υπάρχουν ουσίες που διαλύονται σε μεγάλες ποσότητες σε ένα διαλύτη και ουσίες που διαλύονται σε μικρότερες.
ΜΕΛΕΤΑΜΕ ΤΑ ΔΙΑΛΥΜΑΤΑ
View more presentations or Upload your own.
- Περισσότερα για τα μίγματα εδώ